近日,igenesis公司自主研发生产的核酸提取纯化试剂盒获得IVDR-CE认证,这标志着igenesis公司的产品质量得到国际权威机构的认可和肯定,并获得欧盟市场准入,奠定了坚实的基础。为在欧盟的持续销售奠定基础!


CE认证和IVDR
CE认证被视为产品进入欧洲市场的“签证”,是产品进入欧盟市场的强制性要求。
2022年5月26日起,欧盟正式实施体外诊断医疗器械法规EU 2017/746(IVDR),未获得IVDR CE认证的体外诊断医疗器械不能进入欧盟市场。
新法规旨在建立更加现代化、更加严格的监管框架,以更好地保护公众和患者的健康和安全。新法规IVDR由指令升级为法规。与IVDD指令相比,IVDR对制造商的质量体系以及产品的安全性、有效性和上市后监管提出了更加严格的要求,要求产品满足从生产到终端的可追溯性。
核酸提取纯化试剂盒
lgenesis核酸提取纯化试剂盒旨在提供多样化的分子即时检测解决方案,与第三方检测试剂兼容,提供更多商业可能性。
产品优势
● 磁珠核酸提取技术
● 结果准确:CV值≤5%,符合率100%
● 从复杂的生物样本(拭子、血清、血浆、尿液、痰液、唾液、组织等)中提取核酸
● 固体材料传输+微流控技术
● 预装试剂+冻干专利技术
● 全封闭iCassette,防止污染,确保生物安全
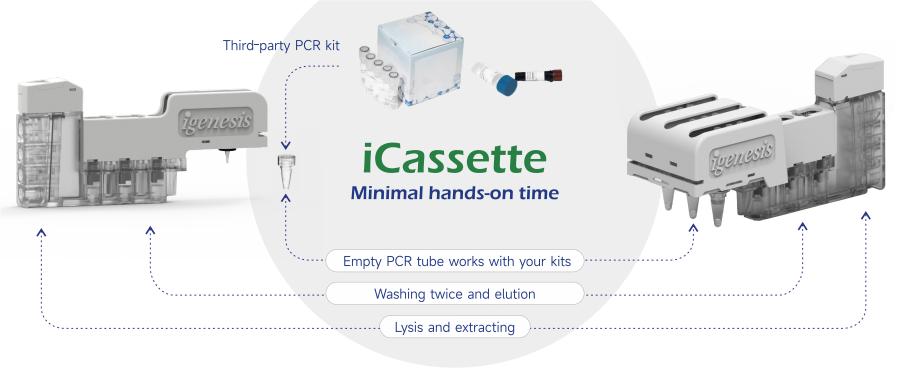
兼容性和灵活性:
● 第三方PCR试剂的适配
● 定制化协作模式
● 7色荧光系统,多达54个多重目标
目前,igenesis已有6个产品获得IVDR-CE标志,海外业务分布全球,如意大利、智利、马来西亚、西班牙、丹麦、香港、中国及欧洲、南美、东南亚等地区。未来,igenesis将始终秉承“诚信、卓越、创新、共赢”的企业理念,为客户提供安全、快捷、方便、准确的POCT解决方案。赋能核酸检测,助推核酸检测试剂POCT。
发布时间:2023年9月1日
