2023年12月19日,Igenesis宣布其自主研发的16、18型人乳头瘤病毒(HPV)16种高危检测及基因分型诊断试剂盒(PCR荧光探针法) 经过泰国公共卫生部严格审查后批准。该试剂已获得泰国医疗器械TFDA注册认证,具备进入泰国医疗器械市场的资格,为当地医疗卫生建设行业做出贡献。这是继智创自动化全封闭qPCR系统Galaxy Nano和Galaxy Lite、结核病核酸检测试剂和核酸提取纯化试剂盒获得泰国医疗器械注册证书后的又一利好消息。
据世界卫生组织(WHO)统计,宫颈癌是全球女性第三大常见癌症,发病率仅次于肺癌和乳腺癌。全球每年约有 60 万名女性被诊断患有宫颈癌,其中约 34 万人死于这种疾病。
2020年11月17日,世界卫生组织(WHO)启动《加速消除宫颈癌全球战略》,强调HPV检测和筛查的重要性。2021年7月6日,世界卫生组织更新发布了《预防宫颈癌:世界卫生组织宫颈癌前病变筛查和治疗指南》,建议HPV DNA检测作为宫颈癌的首选筛查方法。
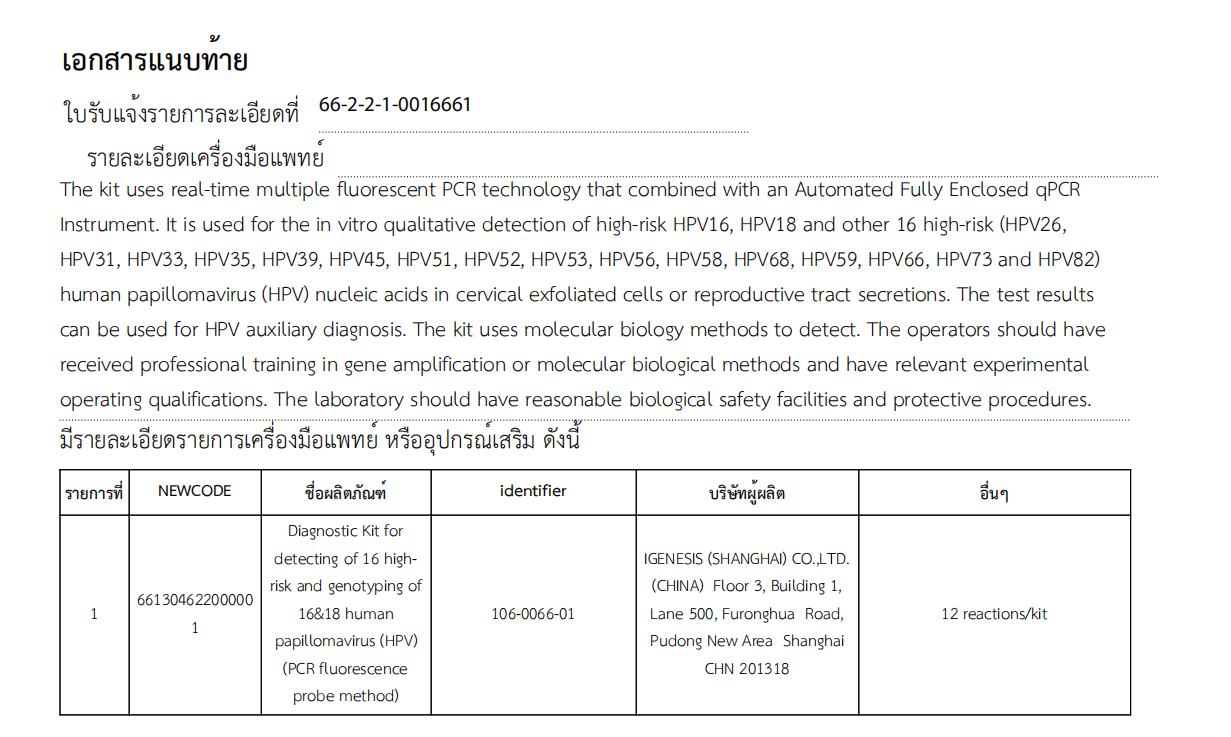
亿创公司16&18型人乳头瘤病毒(HPV)高危型检测及基因分型诊断试剂盒(PCR荧光探针法)可用于高危16型(HPV16)、高危18型(HPV18)、宫颈脱落细胞体外检测人乳头瘤病毒 16 种高危型(HPV26、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV53、HPV56、HPV58、HPV68、HPV59、HPV66、HPV73 和 HPV82)或生殖器分泌物。检测结果可用于HPV辅助诊断,提高宫颈癌筛查效率,有效帮助宫颈癌防控。
HPV核酸检测试剂盒与Galaxy自动化全封闭qPCR系统配合使用,仅需3步即可完成核酸提取、纯化、荧光PCR扩增的全过程。过程全自动、封闭,结果准确可靠。


☑ 结果准确:CV值≤5%,符合率100%;
☑ 操作简便:核酸提取和扩增分析完全自动化,避免人为错误,结果重复性好,可单样本检测,可随时检测;
☑ 使用安全:全封闭iCassette,防止污染,确保生物安全
☑ 固体材料转移+微流控技术;
☑ 预装试剂+冻干专利技术;
☑ 无需冷冻运输。

Igenesis专注于实时分子诊断技术。直到 2023 年 10 月,igenesis 19项试剂及仪器获得CE认证海外业务分布全球,如意大利、智利、马来西亚、西班牙、丹麦、香港、中国及欧洲、南美、东南亚等地区。未来,igenesis将秉承“基因检测的无限可能”的企业理念,不断探索基因检测的无限可能。诚信、卓越、创新、共赢”,为客户提供安全、快捷、方便、准确的分子诊断一体化产品、服务和解决方案。
发布时间:2024年1月16日
