近日,igenesis公司自主研發生產的核酸萃取純化試劑盒獲得IVDR-CE認證,這標誌著igenesis公司的產品品質得到國際權威機構的認可和肯定,並獲得歐盟市場准入,奠定了堅實的基礎。在歐盟的持續銷售奠定基礎!


CE認證和IVDR
CE認證被視為產品進入歐洲市場的“簽證”,是產品進入歐盟市場的強制性要求。
2022年5月26日起,歐盟正式實施體外診斷醫療器材法規EU 2017/746(IVDR),未獲得IVDR CE認證的體外診斷醫療器材無法進入歐盟市場。
新法規旨在建立更現代化、更嚴格的監管框架,以更好地保護公眾和患者的健康和安全。與IVDD指令相比,IVDR對製造商的品質體係以及產品的安全性、有效性和上市後監管提出了更嚴格的要求,要求產品滿足從生產到終端的可追溯性。
核酸萃取純化試劑盒
lgenesis核酸萃取純化試劑盒旨在提供多樣化的分子即時檢測解決方案,與第三方檢測試劑相容,提供更多商業可能性。
產品優勢
● 磁珠核酸萃取技術
● 結果準確:CV值≤5%,符合率100%
● 從複雜的生物樣本(拭子、血清、血漿、尿液、痰液、唾液、組織等)中萃取核酸
●固體材料傳輸+微流控技術
●預載試劑+冷凍乾燥專利技術
●全封閉 iCassette,防止污染,確保生物安全
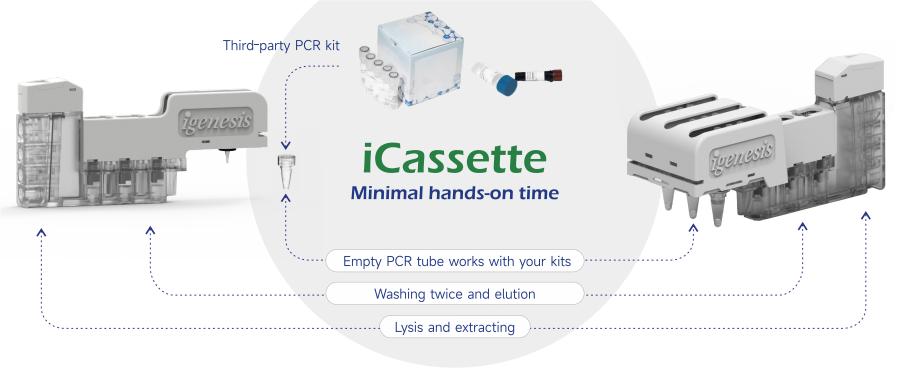
相容性和靈活性:
●第三方PCR試劑的適配
● 客製化協作模式
●7色螢光系統,多達54個多重目標
目前,igenesis已有6個產品獲得IVDR-CE標誌,海外業務分佈全球,如義大利、智利、馬來西亞、西班牙、丹麥、香港、中國及歐洲、南美、東南亞等地區。 、卓越、創新、共贏」的企業理念,為客戶提供安全、快速、方便、準確的POCT解決方案。賦能核酸檢測,助推核酸檢測試劑POCT。
發佈時間:2023年9月1日
