19 grudnia 2023 roku firma Igenesis ogłosiła, że została opracowana niezależnieZestaw diagnostyczny do wykrywania wirusa brodawczaka ludzkiego 16 wysokiego ryzyka i genotypowania 16 i 18 (HPV) (metoda sondy fluorescencyjnej PCR) został zatwierdzony przez tajskie Ministerstwo Zdrowia Publicznego po dokładnej ocenie.Odczynnik uzyskał certyfikat rejestracyjny TFDA wyrobów medycznych w Tajlandii, który kwalifikuje go do wejścia na tajski rynek wyrobów medycznych i wniesienia wkładu w lokalną branżę budownictwa medycznego i zdrowotnego.To kolejna dobra wiadomość dla Igenesis po uzyskaniu przez Tajlandię certyfikatu rejestracji wyrobu medycznego za pomocą zautomatyzowanego, w pełni zamkniętego systemu qPCR – Galaxy Nano i Galaxy Lite, odczynnika do wykrywania kwasu nukleinowego TB oraz zestawu do ekstrakcji i oczyszczania kwasu nukleinowego.
Według Światowej Organizacji Zdrowia (WHO) rak szyjki macicy jest trzecim najczęściej występującym rodzajem nowotworu u kobiet na świecie, a wskaźnik zachorowalności jest jedynie niższy niż rak płuc i piersi.Co roku na całym świecie rak szyjki macicy diagnozuje się u około 600 000 kobiet, a około 340 000 z nich umiera z powodu tej choroby.
17 listopada 2020 r. Światowa Organizacja Zdrowia (WHO) ogłosiła Globalną strategię na rzecz przyspieszenia eliminacji raka szyjki macicy, podkreślając znaczenie badań przesiewowych i badań HPV.6 lipca 2021 r. WHO zaktualizowała i opublikowała dokument „Zapobieganie rakowi szyjki macicy: wytyczne WHO dotyczące badań przesiewowych i leczenia zmian przedrakowych szyjki macicy”, w którym zaleca się badanie DNA wirusa HPV jako preferowaną metodę badań przesiewowych w kierunku raka szyjki macicy.
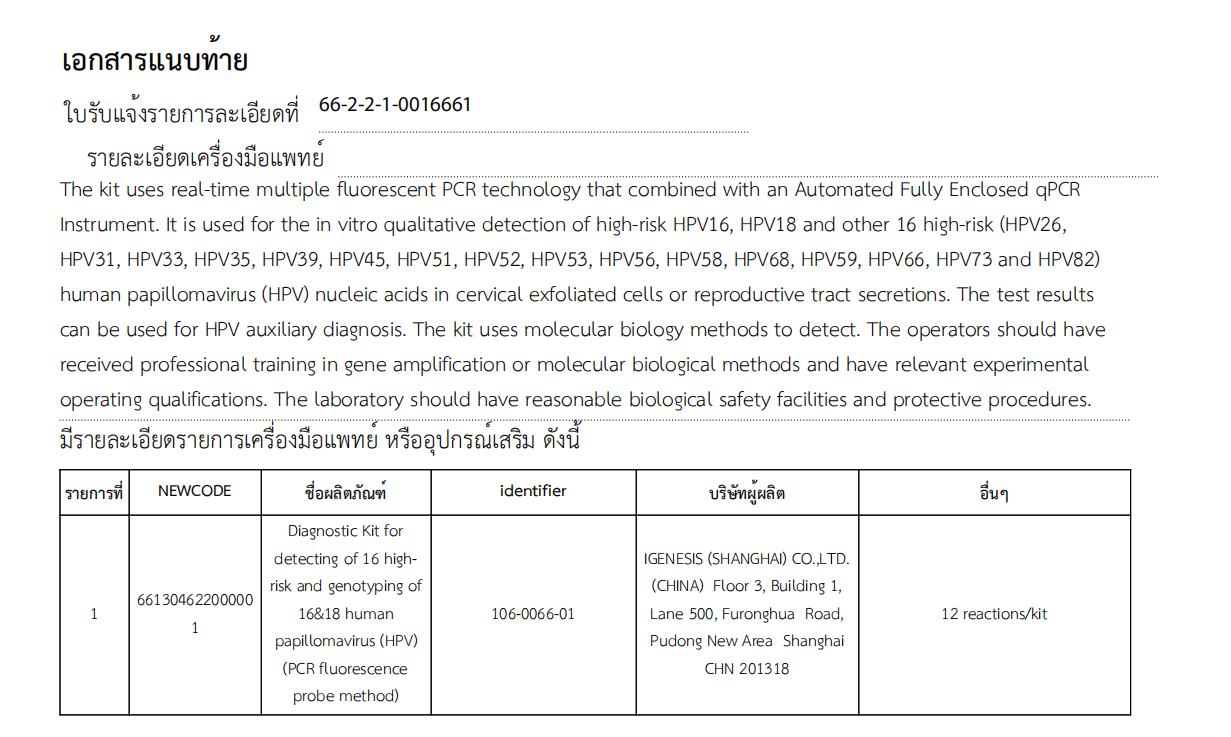
Zestaw diagnostyczny Igenesis do wykrywania 16 typów wirusa brodawczaka ludzkiego wysokiego ryzyka i genotypowania 16&18 (HPV) (metoda sondy fluorescencyjnej PCR) może być stosowany do jakościowego wykrywania 16 typów wysokiego ryzyka (HPV16), 18 typów wysokiego ryzyka (HPV18), i innych 16 typów wysokiego ryzyka (HPV26, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV53, HPV56, HPV58, HPV68, HPV59, HPV66, HPV73 i HPV82) wirusa brodawczaka ludzkiego in vitro z komórek złuszczonych szyjki macicy lub wydzieliny narządów płciowych.Wyniki testu można wykorzystać do diagnostyki wspomaganej wirusem HPV, poprawić skuteczność badań przesiewowych w kierunku raka szyjki macicy oraz skutecznie pomóc w zapobieganiu i kontrolowaniu raka szyjki macicy.
Zestaw do wykrywania kwasów nukleinowych HPV, używany w połączeniu z całkowicie zamkniętym systemem qPCR Galaxy, może zakończyć cały proces ekstrakcji, oczyszczania i amplifikacji fluorescencyjnej PCR w zaledwie 3 krokach.Proces jest w pełni zautomatyzowany i zamknięty, a wyniki są dokładne i wiarygodne.


☑ Dokładne wyniki: wartość CV ≤5%, współczynnik koincydencji 100%;
☑ Łatwa obsługa: ekstrakcja kwasów nukleinowych i analiza amplifikacji są w pełni zautomatyzowane, co pozwala uniknąć błędów ludzkich, zapewnia dobrą powtarzalność wyników, umożliwia wykrycie pojedynczej próbki i można je przetestować w dowolnym momencie;
☑ Bezpieczny w użyciu: całkowicie zamknięta iCassette, zapobiega zanieczyszczeniom, zapewnia bezpieczeństwo biologiczne
☑ Transfer materiału stałego + technologia mikroprzepływowa;
☑ Wstępne ładowanie odczynnika + Opatentowana technologia liofilizacji;
☑ Nie ma potrzeby transportu mrożonek.

Igenesis koncentruje się na technologii diagnostyki molekularnej w czasie rzeczywistym.Do października 2023 r.igenesis uzyskała znak CE dla 19 odczynników i instrumentówDziałalność zagraniczna jest dystrybuowana na całym świecie, na przykład we Włoszech, Chile, Malezji, Hiszpanii, Danii, Hongkongu, Chinach i Europie, Ameryce Południowej, Azji Południowo-Wschodniej i innych regionach.W przyszłości igenesis będzie nadal badać nieskończone możliwości wykrywania genów, zgodnie z filozofią przedsiębiorstwa „uczciwość, doskonałość, innowacyjność i korzyści dla obu stron”i zapewniać klientom bezpieczne, szybkie, wygodne i dokładne zintegrowane produkty, usługi i rozwiązania z zakresu diagnostyki molekularnej.
Czas publikacji: 16 stycznia 2024 r
