最近、igenesis が独自に開発・製造した核酸抽出精製キットが IVDR-CE 認証を取得しました。これは、igenesis の製品品質が国際当局によって認められ、肯定されていることを示し、igenesis は EU 市場へのアクセスを獲得し、確固たる地位を築きました。 EU での継続的な販売の基盤!


CE認証とIVDR
CE 認証は、製品が欧州市場に参入するための「ビザ」とみなされ、EU 市場で製品にアクセスするための必須要件です。
2022 年 5 月 26 日より、欧州連合は体外診断医療機器規制 EU 2017/746 (IVDR) を正式に施行し、IVDR CE 認証を取得していない体外診断医療機器は EU 市場に参入できなくなりました。
新しい規制は、公衆と患者の健康と安全をより良く保護するために、より現代的で厳格な規制枠組みを確立することを目的としています。新しい規制 IVDR は、指令から規制にアップグレードされました。IVDD 指令と比較して、IVDR はメーカーの品質システム、製品の安全性、有効性、市販後の監督についてより厳しい要件を提示し、製品が製造から最終製品までのトレーサビリティを満たすことを要求します。
核酸抽出および精製キット
lgenesis 核酸抽出および精製キットは、さまざまな分子ポイントオブケア検査ソリューションを提供するように設計されており、サードパーティの検出試薬と互換性があり、より多くのビジネスの可能性を提供します。
製品の利点
●磁気ビーズ核酸抽出技術
● 正確な結果: CV 値 ≤ 5%、一致率は 100%
● 複雑な生体サンプル (綿棒、血清、血漿、尿、喀痰、唾液、組織など) から核酸を抽出します。
●固体物質搬送+マイクロ流体技術
●プリロード試薬+特許凍結乾燥技術
● 完全密閉型 iCassette、汚染を防止、バイオセーフティを確保
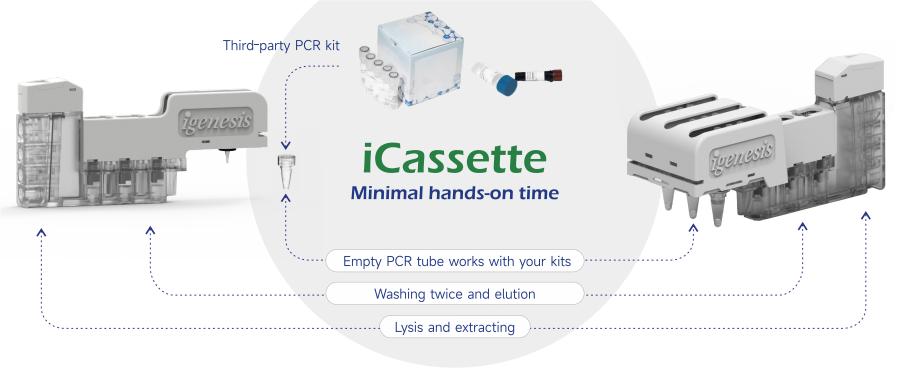
互換性と柔軟性:
● サードパーティ製 PCR 試薬の適応
● カスタマイズされたコラボレーションモード
● 7 色の蛍光システム、最大 54 個のマルチターゲット
現在、igenesis は 6 製品で IVDR-CE マークを取得しており、海外事業はイタリア、チリ、マレーシア、スペイン、デンマーク、香港、中国、ヨーロッパ、南米、東南アジアなどの地域に世界的に展開されています。今後も、igenesis は常に「誠実、卓越性、革新、Win-Win」の企業理念を堅持し、安全、迅速、便利、正確な POCT ソリューションをお客様に提供していきます。核酸検査を強化し、核酸検査試薬の POCT を強化します。
投稿時間: 2023 年 9 月 1 日
