2023 年 12 月 19 日、Igenesis は独自に開発したハイリスク16種の検出および16&18種のヒトパピローマウイルス(HPV)の遺伝子型判定用診断キット(PCR蛍光プローブ法) タイ保健省による厳格な審査を経て承認されました。この試薬は、タイの医療機器のTFDA登録認証を取得しており、これによりタイの医療機器市場に参入し、地元の医療および健康建設業界に貢献することが認められます。これは、同社の自動完全密閉型 qPCR システムである Galaxy Nano および Galaxy Lite、結核核酸検出試薬および核酸抽出精製キットによって取得されたタイの医療機器登録証明書に続く、アイジェネシスにとってのもう 1 つの朗報です。
世界保健機関 (WHO) によると、子宮頸がんは世界中の女性の間で 3 番目に多いがんの種類であり、その発生率は肺がんや乳がんよりも低いだけです。世界中で毎年約60万人の女性が子宮頸がんと診断され、そのうち約34万人がこの病気で死亡しています。
2020年11月17日、世界保健機関(WHO)は子宮頸がんの撲滅を加速する世界戦略を発表し、HPV検査とスクリーニングの重要性を強調しました。2021年7月6日、WHOは「子宮頸がんの予防:子宮頸部の前がん性病変のスクリーニングと治療に関するWHOガイドライン」を更新し発表し、子宮頸がんの好ましいスクリーニング方法としてHPV DNA検査を推奨しました。
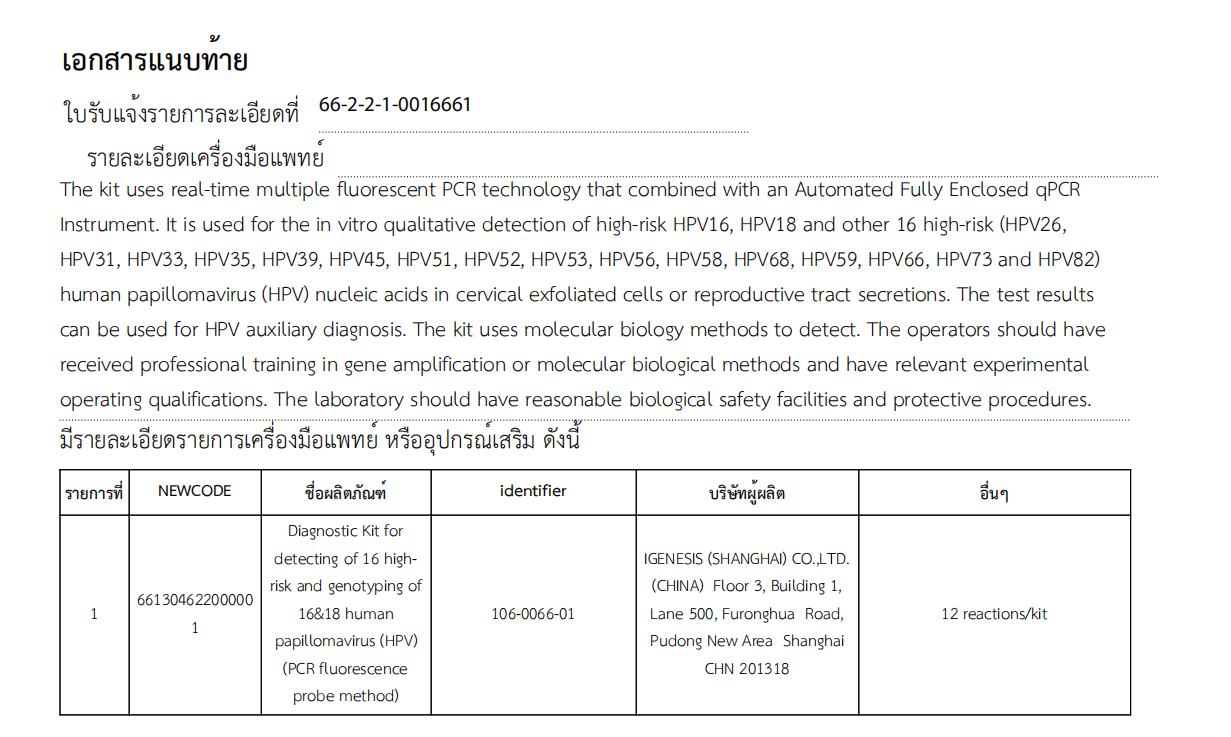
ハイリスク 16 種類の検出および 16&18 ヒトパピローマウイルス (HPV) の遺伝子型決定 (PCR 蛍光プローブ法) のための Igenesis の診断キットは、ハイリスク 16 型 (HPV16)、ハイリスク 18 型 (HPV18) の定性的検出に使用できます。および他の 16 の高リスク型 (HPV26、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV53、HPV56、HPV58、HPV68、HPV59、HPV66、HPV73、および HPV82) の子宮頸部剥離細胞からの in vitro ヒトパピローマウイルスまたは性器分泌物。検査結果は、HPV 支援診断に使用でき、子宮頸がんスクリーニングの効率を向上させ、子宮頸がんの予防と制御に効果的に役立ちます。
HPV 核酸検出キットを Galaxy Automated Fully Enclosed qPCR System と組み合わせて使用すると、核酸抽出、精製、蛍光 PCR 増幅の全プロセスをわずか 3 ステップで完了できます。このプロセスは完全に自動で密閉されており、結果は正確で信頼性があります。


☑ 正確な結果: CV 値 ≤ 5%、一致率は 100%。
☑ 操作が簡単: 核酸の抽出と増幅分析は完全に自動化されており、人的ミスが回避され、結果の再現性が高く、単一サンプルの検出が可能で、いつでもテストできます。
☑ 安全に使用できます: 完全に密閉された iCassette、汚染を防ぎ、バイオセーフティを確保します。
☑ 固体物質移動 + マイクロ流体技術;
☑ 試薬のプレロード + 特許取得済みの凍結乾燥技術。
☑ 冷凍輸送の必要がありません。

Igenesis はリアルタイム分子診断技術に重点を置いています。2023年10月までは、igenesis は 19 の試薬および機器で CE マークを取得しました、海外事業は、イタリア、チリ、マレーシア、スペイン、デンマーク、香港、中国、ヨーロッパ、南米、東南アジア、その他の地域など、世界的に展開されています。今後もアイジェネシスは「」という企業理念のもと、遺伝子検出の無限の可能性を追求し続けます。誠実さ、卓越性、革新性、そして双方にとって有利な関係」を掲げ、お客様に安全、迅速、便利、正確な分子診断統合製品、サービス、ソリューションを提供します。
投稿日時: 2024 年 1 月 16 日
