Am 19. Dezember 2023 gab Igenesis bekannt, dass es unabhängig entwickelt wurdeDiagnosekit zum Nachweis von 16 Hochrisikoviren und zur Genotypisierung von 16 und 18 des humanen Papillomavirus (HPV) (PCR-Fluoreszenzsondenmethode) wurde vom thailändischen Gesundheitsministerium nach strenger Prüfung genehmigt.Das Reagenz hat die TFDA-Registrierungszertifizierung für medizinische Geräte in Thailand erhalten, die es für den Eintritt in den thailändischen Markt für medizinische Geräte und einen Beitrag zur lokalen Medizin- und Gesundheitsbauindustrie qualifiziert.Dies ist eine weitere gute Nachricht für Igenesis, nachdem das thailändische Medizinprodukt-Registrierungszertifikat für sein automatisiertes, vollständig geschlossenes qPCR-System – Galaxy Nano und Galaxy Lite, TB-Nukleinsäure-Nachweisreagenz und Nukleinsäure-Extraktions- und -Reinigungskit – erhalten wurde.
Nach Angaben der Weltgesundheitsorganisation (WHO) ist Gebärmutterhalskrebs weltweit die dritthäufigste Krebsart bei Frauen, die Inzidenzrate liegt nur unter der von Lungen- und Brustkrebs.Jedes Jahr erkranken weltweit etwa 600.000 Frauen an Gebärmutterhalskrebs, etwa 340.000 von ihnen sterben an dieser Krankheit.
Am 17. November 2020 startete die Weltgesundheitsorganisation (WHO) die globale Strategie zur Beschleunigung der Eliminierung von Gebärmutterhalskrebs und betonte dabei die Bedeutung von HPV-Tests und -Screenings.Am 6. Juli 2021 hat die WHO die „Prävention von Gebärmutterhalskrebs: WHO-Leitlinien für das Screening und die Behandlung präkanzeröser Läsionen des Gebärmutterhalses“ aktualisiert und veröffentlicht, die HPV-DNA-Tests als bevorzugte Screening-Methode für Gebärmutterhalskrebs empfiehlt.
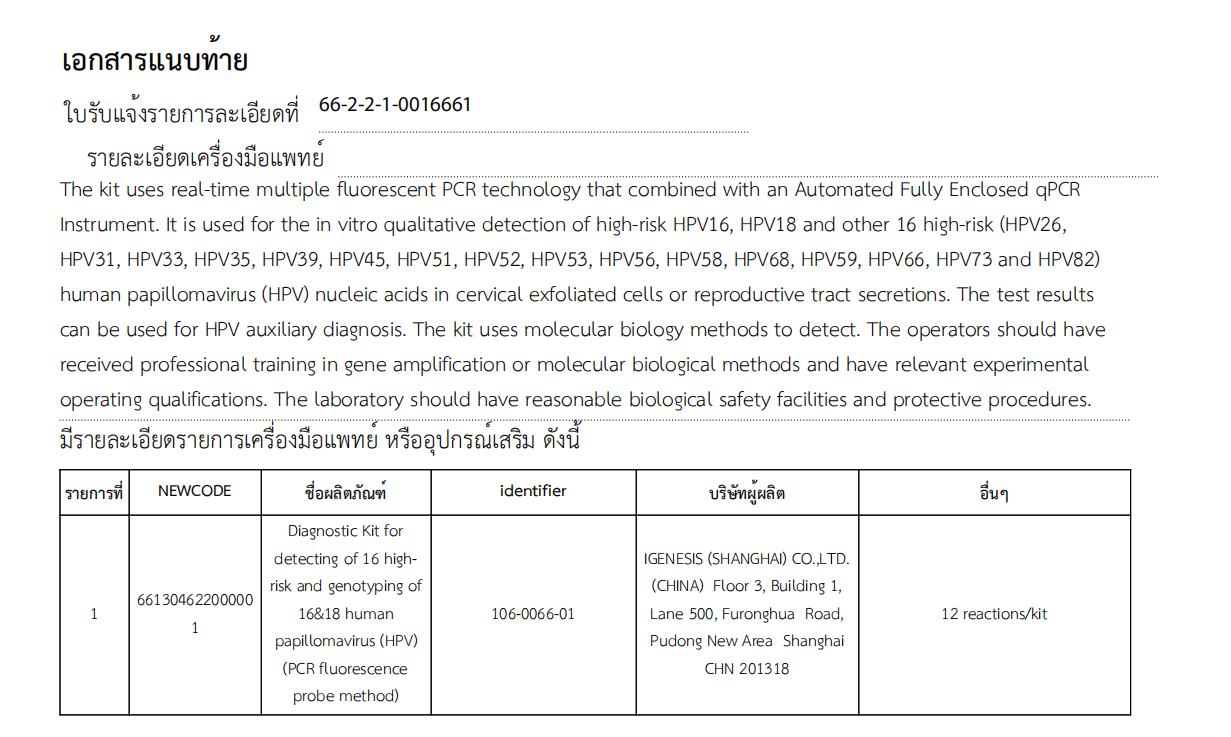
Das Diagnosekit von Igenesis zum Nachweis von 16 Hochrisikotypen und zur Genotypisierung von 16 und 18 humanen Papillomaviren (HPV) (PCR-Fluoreszenzsondenmethode) kann für den qualitativen Nachweis von Hochrisikotypen 16 (HPV16), Hochrisikotypen 18 (HPV18) und und andere 16 Hochrisikotypen (HPV26, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV53, HPV56, HPV58, HPV68, HPV59, HPV66, HPV73 und HPV82) des humanen Papillomavirus in vitro aus zervikalen exfolierten Zellen oder Genitalsekrete.Die Testergebnisse können zur HPV-gestützten Diagnose genutzt werden, die Effizienz der Gebärmutterhalskrebs-Früherkennung verbessern und wirksam zur Vorbeugung und Kontrolle von Gebärmutterhalskrebs beitragen.
Das HPV-Nukleinsäure-Nachweiskit kann in Verbindung mit dem Galaxy Automated Fully Enclosed qPCR System den gesamten Prozess der Nukleinsäureextraktion, -reinigung und Fluoreszenz-PCR-Amplifikation in nur drei Schritten abschließen.Der Prozess ist vollautomatisch und geschlossen und die Ergebnisse sind genau und zuverlässig.


☑ Genaue Ergebnisse: CV-Wert ≤5 %, Übereinstimmungsrate beträgt 100 %;
☑ Einfach zu bedienen: Die Extraktion und Amplifikationsanalyse von Nukleinsäuren erfolgt vollständig automatisiert, wodurch menschliche Fehler vermieden werden, die Ergebnisse gut wiederholbar sind, eine Einzelprobendetektion möglich ist und jederzeit getestet werden kann;
☑ Sicher in der Anwendung: Vollständig geschlossene iCassette, Vermeidung von Umweltverschmutzung, Gewährleistung der Biosicherheit
☑ Feststofftransfer + Mikrofluidik-Technologie;
☑ Vorladen des Reagenzes + patentierte Gefriertrocknungstechnologie;
☑ Kein Tiefkühltransport erforderlich.

Igenesis konzentriert sich auf Echtzeit-Molekulardiagnostiktechnologie.Bis Oktober 2023,igenesis hat die CE-Kennzeichnung für 19 Reagenzien und Instrumente erhaltenDas Auslandsgeschäft ist weltweit verteilt, beispielsweise in Italien, Chile, Malaysia, Spanien, Dänemark, Hongkong, China und Europa, Südamerika, Südostasien und anderen Regionen.Auch in Zukunft wird Genesis die unendlichen Möglichkeiten der Generkennung mit der Unternehmensphilosophie „Integrität, Exzellenz, Innovation und Win-Win-Situation“ und bieten Kunden sichere, schnelle, bequeme und genaue integrierte Produkte, Dienstleistungen und Lösungen für die Molekulardiagnostik.
Zeitpunkt der Veröffentlichung: 16. Januar 2024
